Pada awal perkembangan kimia organik, para ilmuwan memahami bahwa molekul terdiri dari atom-atom yang saling terhubung melalui ikatan kimia. Namun, bentuk tiga dimensi molekul masih menjadi teka-teki besar, karena tidak bisa diamati secara langsung. Waktu itu, para ahli hanya mengandalkan gambar datar untuk merepresentasikan struktur kimia.
Sampai akhirnya, pada tahun 1874, seorang kimiawan bernama Van’t Hoff membuat terobosan: ia menyatakan bahwa empat ikatan dalam atom karbon jenuh tidak berada pada bidang datar, melainkan mengarah ke empat sudut sebuah tetrahedron (bentuk seperti piramida segitiga). Klaim ini kemudian terbukti secara teori lewat revolusi kuantum puluhan tahun kemudian.
Van’t Hoff mendasarkan teorinya pada fenomena rotasi cahaya terpolarisasi. Ia memperhatikan bahwa hanya senyawa dengan karbon pusat yang terikat pada empat atom atau gugus berbeda yang dapat memutar cahaya terpolarisasi. Artinya, senyawa tersebut punya sifat yang unik.
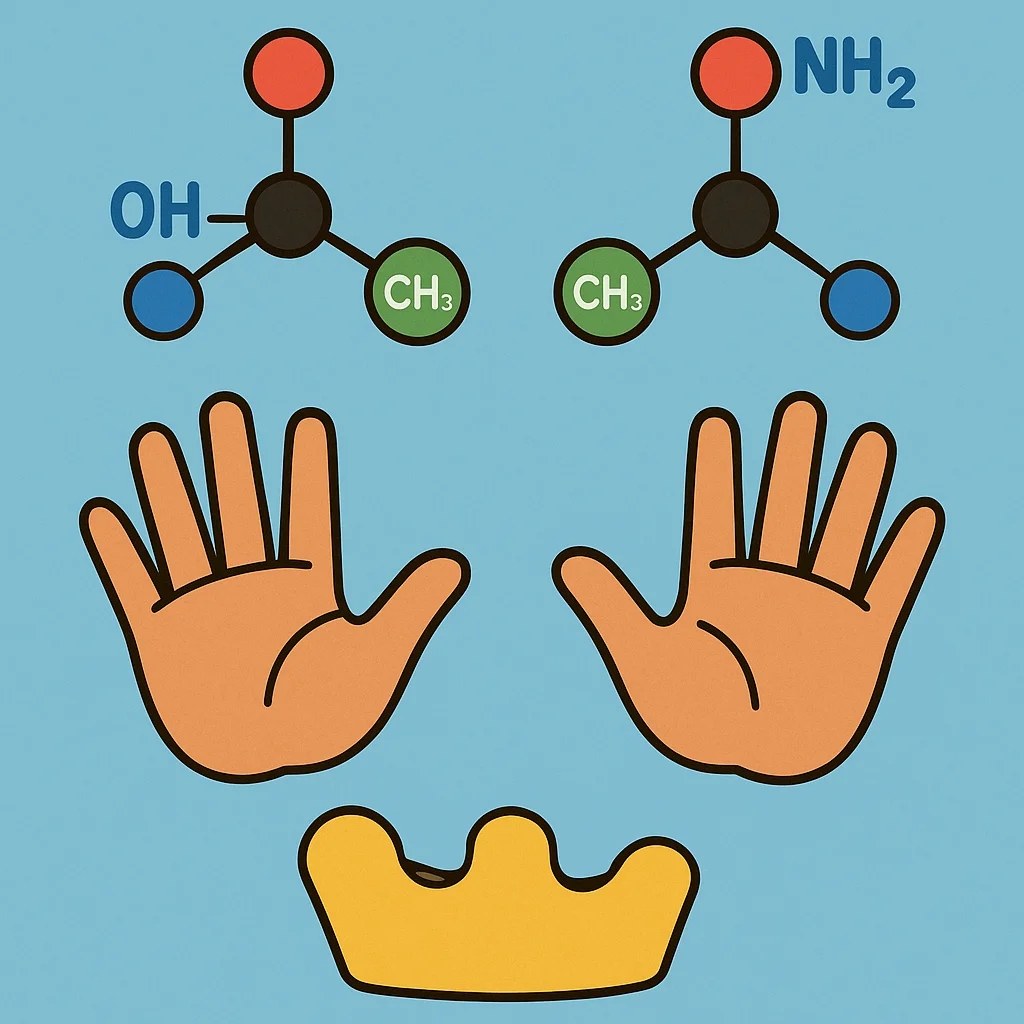
Mari kita lihat dua molekul dengan karbon pusat yang terikat pada bromin, klorin, fluor, dan hidrogen. Meskipun tampak sama dalam komposisi, tidak mungkin menumpuk keduanya secara sempurna. Inilah tanda bahwa mereka adalah bayangan cermin satu sama lain.
Untuk memahaminya, coba perhatikan tanganmu. Keduanya memiliki bagian yang sama—ibu jari, telapak, jari-jari—dan memiliki jarak antar bagian yang serupa. Tapi tetap saja, tangan kanan tidak bisa ditumpuk sempurna di atas tangan kiri. Mereka adalah objek chiral—tidak identik dengan bayangan cerminnya.
Dalam dunia kimia, fenomena ini disebut chirality. Objek chiral tidak identik dengan bayangan cerminnya, walaupun memiliki komponen dan ukuran yang sama. Ini bukan hanya konsep visual—chirality punya pengaruh nyata dalam dunia nyata.
Misalnya, cahaya terpolarisasi memiliki bagian yang “berputar” searah jarum jam (right-handed) dan berlawanan arah (left-handed). Molekul chiral bisa memperlambat salah satu sisi cahaya ini, menyebabkan terjadinya optical rotation—fenomena yang pertama kali diamati oleh Van’t Hoff.
Tidak hanya di laboratorium, chirality juga hadir di kehidupan sehari-hari: dari sekrup kanan dan kiri, rakitan furnitur, hingga gerakan tangan saat kita bertepuk tangan. Menariknya, meskipun manusia menyukai simetri, objek chiral buatan manusia jarang ditemukan—namun molekul chiral ada di mana-mana di alam.
Kirality adalah contoh sempurna bagaimana struktur mikroskopis molekul dapat memengaruhi perilaku makroskopis dalam cahaya, reaksi kimia, dan bahkan aplikasi industri. Satu perubahan kecil dalam orientasi atom—dan dunia bisa berubah secara signifikan.

Leave a Reply
You must be logged in to post a comment.